
当前位置:首页 > 实验服务 > 蛋白质免疫检测技术服务
探寻生命奥秘,蛋白免疫印迹(Western Blot)如一把生物学解码器,为我们揭示蛋白质的神秘面纱。它的原理简单而玄妙,通过电泳分离、传递和检测蛋白质,将微观的生命活动呈现在实验室的荧屏上。今天九游国际生物带大家学习蛋白免疫印迹western blot的基本原理和实践操作!

免疫印迹western blot实验操作
简介
免疫印迹,又被称为蛋白质印迹(Western blot,WB),是一种复合性的免疫学检测技术。该方法通过利用SDS-PAGE技术,在生物样本中将蛋白质分子根据其分子量在凝胶上进行分离,随后通过电转移的方式将这些蛋白质转移到固相膜上。固相膜上的蛋白质充当抗原,与相应的抗体发生免疫反应,接着与酶标记的第二抗体发生反应。最终,通过底物显色或荧光成像等手段,检测电泳分离的特异性目的基因表达的蛋白质。
该技术被广泛应用于研究基因在蛋白质水平的表达、检测抗体活性以及早期诊断疾病等多个领域。
实验原理
蛋白质免疫印迹法,即Western Blot,基本原理涉及通过PAGE(聚丙烯酰胺凝胶电泳)对蛋白质样品进行分离,随后将其转移至固相载体,如硝酸纤维素薄膜(NC膜)或PVDF膜。固相载体以非共价键方式吸附蛋白质,同时能够保持电泳分离的多肽类型及其生物学活性的不变性。
在该过程中,固相载体上的蛋白质或多肽被作为抗原,与相应的抗体发生免疫反应,随后与酶或同位素标记的第二抗体发生反应。最终,通过底物显色或放射自显影等手段,实现对电泳分离的特异性目的基因表达的蛋白成分的检测。
这一方法的关键在于其能够通过将蛋白质固定在固相载体上并与特异性抗体相互作用,从而实现对目标蛋白的高灵敏度和高特异性检测。这种分析手段在研究蛋白质表达和功能、抗体诊断以及生物医学研究中发挥着重要的作用。
应用
(1) 从蛋白质混合物中检出目标蛋白质;
(2) 定量或定性确定细胞或组织中蛋白质的表达情况;
(3) 用于蛋白质-蛋白质、蛋白质-DNA、蛋白质-RNA相互作用后续分析;
实验流程
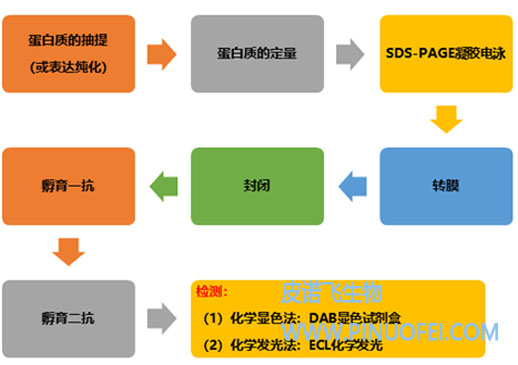
WB常规实验流程
步骤:
一、试剂准备
二、蛋白样品制备
三、蛋白含量的测定
四、SDS - PAGE电泳
五、转膜
六、免疫反应
七、化学发光,显影,定影
八、凝胶图象分析
实验准备
实验材料:蛋白质样品。
试剂、试剂盒:裂解液 PBS G 250考马斯亮蓝溶液 NaCl SDS上样缓冲液 电泳缓冲液 转移缓冲液 丽春红染液 封闭液 TBST TBS 洗脱抗体缓冲液 显影液 定影液 抗体 化学发光试剂。
仪器、耗材:高压锅 玻璃匀浆器 高速离心机 分光光度仪 -20℃低温冰箱 垂直板电泳转移装置 恒温水浴摇床 多用脱色摇床。
实验步骤
一、蛋白样品的制备
1.单层贴壁细胞总蛋白的提取:
①去除培养液,并将培养瓶倒扣在吸水纸上,确保吸水纸充分吸取残余培养液(或者将瓶直立放置片刻,使残余培养液流至瓶底,然后用移液器吸取)。
②向每个培养瓶中加入3 ml 4℃预冷的PBS(0.01 M pH 7.2~7.3)。轻轻摇晃培养瓶进行1分钟的细胞洗涤,然后弃去洗液。重复上述步骤两次,总共进行三次洗涤以去除培养液。将PBS弃净后,将培养瓶放置于冰上。
③在冰上,向每瓶中加入1 ml裂解液,并加入10 μl PMSF(100 mM)。摇匀混合。(PMSF应在无结晶的情况下摇匀再与裂解液混合。)
④向每个培养瓶中加入400 μl含PMSF的裂解液,放置于冰上裂解30分钟。为确保细胞充分裂解,要经常来回摇动培养瓶。
⑤裂解完成后,迅速用干净的刮棒将细胞从培养瓶的一侧刮下(动作迅速),然后用枪将细胞碎片和裂解液转移到1.5 ml 离心管中。整个操作最好在冰上进行。
⑥在4℃下进行12000 rpm离心5分钟(提前开启离心机进行预冷)。
⑦将离心后的上清分装至0.5 ml 离心管中,迅速转移到-20℃保存。
2.组织中总蛋白的提取:
①取少量组织块并置于1~2 ml 匀浆器的球状部位,使用清洁的剪刀将组织块彻底剪碎。
②向匀浆器中加入400 ml含有PMSF的单一去污剂裂解液,进行匀浆。随后将匀浆器置于冰上。
③过几分钟后,再次进行碾磨,然后再次放置于冰上。这个过程需要重复几次,以确保组织块充分碾碎。
④裂解30分钟后,使用移液器将裂解液转移至1.5 ml 离心管中。随后,在4℃下进行12000 rpm离心5分钟,将上清液分装至0.5 ml 离心管中,并存放于-20℃。
3.加药物处理的贴壁细胞总蛋白的提取:
①将培养液转移至1.5 ml 离心管中,进行2500 rpm 离心5分钟。
②丢弃上清液,加入4 ml 冷却至4℃的PBS,并轻轻使用枪进行吹洗,然后再次进行2500 rpm 离心5分钟。丢弃上清液后,用PBS重复洗涤一次。
③使用枪将细胞洗净后,向每个培养瓶中加入含有PMSF的100 μl裂解液,并进行在冰上的裂解,持续30分钟。在裂解过程中,要定期轻轻弹动以确保细胞充分裂解。
④将裂解液与培养瓶中的裂解液混合后,在4℃下进行12000 rpm离心5分钟。
⑤将离心后的上清液分装至0.5 ml 离心管中,并迅速放置于-20℃保存。
二、蛋白含量的测定
(1) 制作标准曲线
①制备BSA溶液:
从-20℃取出1 mg/ml BSA,并在室温下融化,备用。
②准备离心管组:
取18个1.5 ml 离心管,按3个一组进行分组,并为每组分别标记为0 μg,2.5 μg,5.0 μg,10.0 μg,20.0 μg,40.0 μg。
③添加试剂:
根据以下表格,在各个离心管中加入相应的试剂。
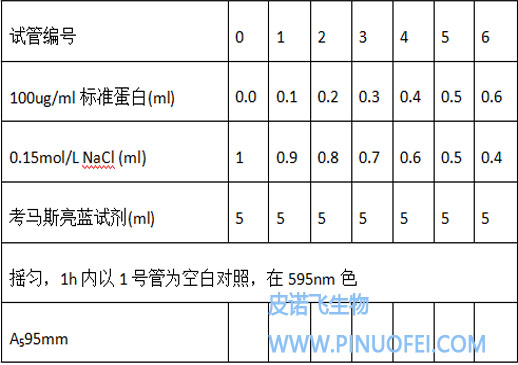
④混匀步骤:
将混合后的样品在室温下放置2分钟,以确保样品充分混合。
⑤比色分析:
使用生物分光光度计(Bio-Photometer,Eppentoff)进行比色分析。
将混匀后的样品分别加载到生物分光光度计的测量室。
通过设定合适的波长,测量吸光度,并记录相应的数据。
(2) 检测样品蛋白含量
①准备考马斯亮蓝溶液:
取足量的1.5 ml 离心管,每管加入1 ml 4℃储存的考马斯亮蓝溶液。在室温下放置30分钟,使其充分与蛋白发生反应。
②制备空白样品:
取一管考马斯亮蓝,加入0.15 mol/L NaCl溶液100 μl。混匀后放置2分钟,作为空白样品。将空白倒入比色杯中,按照标准曲线程序下进行测量。
③清洗比色杯:
弃空白样品,用无水乙醇清洗比色杯2次(每次0.5 ml),然后用无菌水洗一次。
④测量样品:
取一管考马斯亮蓝,加入95 μl 0.15 mol/L NaCl NaCl溶液和5 μl待测蛋白样品。混匀后静置2分钟,倒入扣干的比色杯中,按照标准曲线程序下进行测量。
注意事项:
在每次测量样品之前,都要用无水乙醇清洗比色杯2次,然后用无菌水洗一次。
可以同时混合多个样品再一起测,以提高效率。测得的结果即为5 μl样品所含的蛋白量。
三、SDS - PAGE电泳
(1) 清洗玻璃板:
①一只手扣紧玻璃板,另一只手蘸点洗衣粉轻轻擦洗。
②两面都擦洗过后用自来水冲,再用蒸馏水冲洗干净后立在筐里晾干。
(2) 灌胶与上样:
① 将玻璃板对齐后放入夹中卡紧,然后垂直卡在架子上准备灌胶。操作时要使两玻璃对齐,以免漏胶。
② 配制10%分离胶,加入TEMED后摇匀即可灌胶。灌胶时,可用10 ml 枪吸取5 ml 胶沿玻璃放出,待胶面升到绿带中间线高度时即可。加一层水,液封后的胶凝固更快。
③当水和胶之间有一条折射线时,说明胶已凝。等3 min 使胶充分凝固,然后倒去胶上层水并用吸水纸将水吸干。
④配制4%的浓缩胶,加入TEMED后灌胶。将剩余空间灌满浓缩胶,然后插入梳子。灌胶时胶要沿玻璃板流下,插梳子时梳子要水平。胶凝固时要在两边补胶,待浓缩胶凝固后,将梳子轻轻拔出。
⑤用水冲洗一下浓缩胶,将其放入电泳槽中。小玻璃板面向内,大玻璃板面向外,若只跑一块胶,那槽另一边要垫一块塑料板,有字的一面面向外。
(3) 上样:
①测完蛋白含量后,计算含50 μg蛋白的溶液体积即为上样量。取出上样样品至0.5 ml 离心管中,加入5×SDS 上样缓冲液至终浓度为1×。
②上样前要将样品于沸水中煮5 min使蛋白变性。
③加足够的电泳液后,用微量进样器贴壁吸取样品,将样品吸出不要吸进气泡。将加样器针头插至加样孔中缓慢加入样品。
(4) 电泳:
电泳时间一般为4~5小时,电压为40 V或60 V。电泳至溴酚兰刚跑出即可终止电泳,准备进行转膜。
四、转膜
(1) 膜的准备:
①戴手套,准备6张直径为7.0~8.3 cm的滤纸和1张直径为7.3~8.6 cm的硝酸纤维素膜。
②将硝酸纤维素膜浸泡于水中2小时,使用镊子捏住膜一侧轻轻放入水中,确保膜浮在水表面,避免形成气泡层。
③将浸过水的膜取出晾干备用。手上的蛋白容易污染膜,因此切滤纸和膜时务必佩戴手套。
(2) 转膜装置的准备:
①在搪瓷盘中放入转膜用夹子、两块海绵垫、一支玻棒、滤纸和浸过的膜。
②将夹子打开,使黑色一面保持水平。在上面垫一张海绵垫,用玻棒反复擀几次以排除气泡,一手擀另一手要压住垫子以保持固定。在垫子上叠放三层滤纸,用玻棒擀去其中的气泡。
(3) 胶的处理:
①将玻璃板撬掉,小心撬除小玻璃板,刮去浓缩胶,注意避免刮破分离胶。
②将分离胶盖在滤纸上,用手调整使其对齐,用玻棒擀去气泡。将膜盖在胶上,确保盖满整个胶,并排除气泡。
③在膜上盖3张滤纸并去除气泡。然后盖上另一块海绵垫,擀几下后合上夹子。整个操作在转移液中进行,不断擀去气泡。确保膜两边的滤纸不相互接触,以避免短路。转移液含甲醇,操作时要戴手套,保持实验室通风。
(4) 电转移:
①将夹子放入转移槽中,确保夹子的黑色一面对着槽的黑面,夹子的白色一面对着槽的红面。槽的一侧放置冰块来降温,因为电转移会产生热。
②电转移一般使用60 V转移2小时或40 V转移3小时。
(5) 膜的染色:
①转移完成后,将膜用1×丽春红染液染5分钟,使用脱色摇床摇动。
②用水冲洗去没染上的染液,观察膜上的蛋白。将膜晾干备用。
五、免疫反应
(1) 封闭和初步洗膜:
①将转膜用TBS(三倍体积)从底部向上浸湿。
②移至含有封闭液的平皿中,室温下在脱色摇床上摇动1小时。
(2) 一抗处理:
①将一抗用TBST稀释至适当浓度,准备好在1.5 ml 离心管中。
②在实验台面上撕下适当大小的保鲜膜,并用水浸湿四角,使其平整。
③将抗体溶液均匀涂抹在保鲜膜上。
④从封闭液中取出膜,用滤纸吸去残留液后,将膜蛋白面朝下放在抗体液上。
⑤轻轻掀动膜的四角以排出残留气泡。
⑥在室温下孵育1~2小时后,用TBST在脱色摇床上洗两次,每次10分钟。
⑦再用TBS洗一次,10分钟。
(3) 二抗处理和最终洗膜:
①用类似的步骤准备二抗稀释液。
②将二抗溶液均匀涂抹在膜上,室温下孵育1~2小时。
③用TBST在脱色摇床上洗两次,每次10分钟。
④再用TBS洗一次,10分钟。
⑤进行化学发光反应。
六. 化学发光,显影,定影
(1) 混合试剂与膜接触:
①在保鲜膜上等体积混合试剂A和B。
②等待1分钟,将膜蛋白面朝下与混合液充分接触。
③过1分钟,将膜移到另一张保鲜膜上,去尽残液,包好,并放入X-光片夹中。
(2) 显影与定影:
①在暗室中,将1×显影液和定影液分别加入塑料盘中。
②在红灯下取出X-光片,使用切纸刀剪裁适当大小(比膜的长和宽均需大1 cm)。
③打开X-光片夹,将X-光片放在膜上,一旦放上,不能移动,关上X-光片夹,开始计时。
④根据信号强弱调整曝光时间,通常为1分钟或5分钟,也可选择不同时间多次压片,以达到较佳效果。
⑤曝光完成后,打开X-光片夹,迅速浸入显影液中显影。待出现明显条带后,立即终止显影。显影时间一般为1~2分钟(20~25℃)。温度较低时需适当延长显影时间。
⑥显影结束后,将X-光片浸入定影液中,定影时间一般为5~10分钟,以胶片透明为止。
⑦用自来水冲去残留的定影液后,室温下晾干。
注意事项:显影和定影时移动胶片时,尽量拿胶片一角,避免手指甲划伤胶片,以免影响结果。
七、 凝胶图象分析
使用凝胶图像处理系统对蛋白免疫印迹实验的胶片进行扫描或拍照,以进行目标带的分子量和净光密度值的分析。
各位科研小伙伴,若您刚好需要做科研实验,诚挚欢迎您与我们联系!九游国际生物以生物医学领域的专业服务为您提供更全面的支持,涵盖动物行为学检测、细胞实验、病理学检测以及免疫学检测等多方面的科研技术服务。